Ikatan
kovalen tidak hanya terbentuk dalam senyawa karbon, tetapi juga dapat dibentk
oleh atom-atom lain, dan Banyak gugus fungsi penting dalam senyawa organik
mengandung nitrogen dan oksigen. Semua ikatan kovalen yang di bentuk oleh
unsur-unsur dalam tabel periodik dapat dijelaskan dengan orbital hibrida. Secara prinsip, pembentukan hibrida sama pada
atom karbon.
- ATOM NITROGEN
- AMINA
Pada diagram orbital nitrogen dapat menghibridasi
keempat orbital atom tingkat kedua menjadi empat orbital ikatan sp3 yang ekuivalen. Namun,
ada satu perbedaan penting antara nitrogen dan oksigen, yaitu karbon mempunyai
empat elektron untuk dibagikan dalam empat orbital sp3, sedangkan atom nitrogen mempunyai lima elektron
yang didistribusikan dalam empat orbital sp3.
Satu orbital sp3 dari
nitrogen diisi dengan sepang elektron, dan nitrogen dapat membentuk senyawa
dengan hanya tiga ikatan kovalen terhadap atom lain.
Pada molekul amina mengandung atom nitrogen sp3 yang terikat pada tiga atom hidrogen, satu
atau lebih atom karbon. Dalam amina, nitrogen mempunyai orbital yang terisi
dengan pasangan elektron valensi
menyendiri. Pasangan elektron menyediri dalam orbital tersisi pada nitrogen
dari amina memungkinkan senyawa ini berfungsi sebagai basa. Jika amina
diperlakukan dengan asam, elektron yang terbagi diunakan untuk membentuk ikatan
sigma dengan asam yang menghasilkan garam amina.
Sama dengan karbon, nitrogen juga ditemukan dalam
senyawa organik dalam keadaan hibrida sp2 dan sp.
Perbedaan antara nitrogen dan karbon adalah satu orbital dari nitrogen terisi
dengan sepasang elektron yang menyendiri.
- AMONIA
Amonia, NH3, salah satu contoh molekul yang
mengandungikatan kovalen yang melibatkan atom nitrogen. Atom nitrogen memiliki
konfigurasi ground-state: 1s2 2s2 2px1 2py1 2pz1, dan memungkinkan atom
nitrogen berikatan dengan tiga atom hidrogen.
Ketika terdapat tiga elektron tak berpasangan
mengisi orbital 2p, ini memungkinkan orbital 1s dari hidrogen untuk overlap
dengan orbital 2p tersebut membentuk ikatan sigma. Sudut ikatan yang terbentuk
adalah 107.30, mendekati sudut tetrahedral (109.50). Nitrogen memiliki lima
elektron pada kulit terluarnya. Pada hibridisasi sp3, satu orbital sp3 diisi
oleh dua elektron dan tiga orbital sp3 diisi masing-masing satu elektron.
Ikatan sigma terbentuk dari overlap orbital hibrida
sp3 yang tidak berpasangan tersebut dengan orbital 1s dari hidrogen
menghasilkan molekul ammonia. Dengan demikian, ammonia
memiliki bentuk geometri tetrahedral yang mirip
dengan metana. Ikatan N-H memiliki panjang 1.01 A dan kekuatan ikatan 103
kkal/mol.
Nitrogen memiliki tiga elektron tak berpasangan pada
orbital hibrid sp3, ketika satu elektron dalam orbital hibrida tersebut
tereksitasi ke orbital p maka terbentuk hibrida baru, yaitu sp2. Elektron
pada orbital p digunakan untuk membentuk ikatan pi.
Jadi, atom nitrogen yang terhibridisasi sp2
memiliki satu ikatan pi yang digunakan untuk membentuk ikatan rangkap dua,
mirip dengan
molekul etena. Apabila elektron yang tereksitasi ke
orbital p ada duamaka nitrogen memiliki
kemampuan membentuk dua ikatan pi atau satu ikatan rangkap tiga
(hibridisasi sp).
Analog dengan karbon, maka dapat diharapkan bahwa
sudut ikatan H–N–H dalam NH3 adalah 109,5°. Percobaan menunjukan bahwa
sudut ikatan NH3 adalah 107,3°. Karena sudut ikatan ditekan oleh
orbital yang terisi dengan elektron menyendiri yang besar ukurannya, elektron
dalam orbital terisi ditarik hanya ke satu inti saja dan bukan ke dua inti,
maka elektron terika kurang erat. Oleh sebab itu, orbital yang terisi lebih
besar dari pada orbital sigma N-H. Jika atom selain hidrogen terikat ke
nitrogen sp3,sudut ikatan
yang diamati lebih dekat ke sudut tetrahedral 109,5° karena tolakan antara
gugus yang lebih besar ini.
2. ATOM OKSIGEN
2. ATOM OKSIGEN
Elektron pada ground-state atom oksigen memiliki
konfigurasi: 1s2 2s2 2px2 2py1 2pz1, dan oksigen merupakan atom divalen.
konfiurasi air di atas, dapat di prediksikan bahwa
oksigen mampu membentuk dua ikatan sigma karena pada kulit terluarnya terdapat
dua elektron tak berpasangan (2py dan 2pz).
Air adalah contoh senyawa yang mengandung oksigen sp3. Sudut ikatan yang
terbentuk sebesar 104,5°, diperkirakan bahwa orbital dengan pasangan elektron
bebas menekan sudut ikatan H–O–H, sehingga sudut yang terbentuk lebih kecil
dari sudut ideal (109,5°), seperti halnya pasangan elektron bebas dalam amonia
menekan sudut H-N-H.
Oksigen juga dapat terhibridisasi sp2, yaitu dengan
mempromosikan satu elektronnya ke orbital p.
Dalam kondisi ini, oksigen hanya memiliki satu
ikatan sigma, tetapi juga memilki satu ikatan pi. Contoh molekul yang memiliki
atom oksigen terhibridisasi sp2 adalah pada senyawa-senyawa karbonil.
Satu contoh terakhir dari hibridisasi orbital yang
sering ditemukan adalah boron trifluorida, BF3. Boron hanya memiliki tiga
elektron di kulit terluarnya (1s2 2s2 2px1), hal ini berarti bahwa boron hanya
dapat membentuk paling banyak tiga ikatan. Kita dapat mempromosikan elektron
pada orbital 2s ke orbital 2py, akan tetapi tidak mungkin melengkapi boron
dengan elektron oktet.
Boron tidak memiliki pasangan elektron bebas,
sehingga terdapat satu orbital p (2pz) yang kosong. Molekul BF3 yang terbentuk
memiliki geometri planar, sehingga dapat dikatakan bahwa boron terhibridisasi
sp2.
IKATAN RANGKAP TERKONJUGASI
Molekul dapat mengandung lebih dari satu gugus
fungsi. Dalam kebanyakan senyawa polifungsional, ada dua cara pokok untuk
menempatkan ikatan rangkap dalam senyawa organik. Dua ikatan rangkap yang
bersumber pada atom berdampingan disebut ikatan rangkap terkonjugasi.
Ikatan rangkap yang menggabungkan atom yang tak
berdampingan disebut ikatan rangkap terisolasi, atau tidak terkonjugasi.
Ikatan rangkap terisolasi bersifat mandiri,
masing-masing ikatan rangkap memberikan reaksi seakan-akan yang lain tidak ada.
Ikatan rangkap terkonjungasi, tidak saling andiri yang satu terhadap yang lain,
ada interaksi elektronik yang terdapat antara 1,3-butadiena.
Atom karbon dari 1,3-butadiena ada dua pasang
orbital p yang membentuk dua ikatan
pi. Satu ikatan pi antara karbon 1 dan 2, dan satu ikatan pi antara karbon 3
dan 4. Namun, orbital p antara karbon
2 dan 3 juga berdampingan, dan tumpang tindih sebagian antara orbital p terjadi. Meskipun kebanyakan rapat
elektron pi berkedudukan antara karbon 1-2 dan 3-4, sedikit rapat, elektron pi
juga ditemukan antara karbon 2-3 .
Beberapa istilah digunakan untuk menggambarkan
interaksi ikatan pi dalam sisem terkonjugasi. Dapat juga dikatakan bahwa ada
tumpang tindih sebagian dari orbital p
antara karbon pusat. Dapat dikatakan juga bahwa ikatan antara karbon 2 dan 3
dalam 1,3-butadienamempunyai karakter ikatan rangkap sebagian. Cara lain untuk
menggambakan sistem adalah mengatakan bahwa elektron pi terdelokalisasi, yang
berarti bahwa rapat elektron pi terdistribusi terbatas pada dua inti, ikatan
rangkap tidak terkonjugasi mengandung elektron pi terlokalisasi.
BENZENA DAN RESONANSI
- Benzen
Benzen (C6H6) adalah senyawa
siklik dengan enam atom karbon yang tergabung dalam cincin. Setiap atom karbon
terhibridisasi sp2 dan
cincinnya adalah planar. Setiap atom karbon mempunyai atom hidrogen yang
terikat padanya, dan setiap atom karbon juga mempunyai orbital p tidak terhibridasi tegak lurus
terhadap bidang iktatan sigma dari cincin. Masing-masing dari keenam orbital p ini dapat menyumbang satu elektron
untuk ikatan pi.
Dengan enam elektron p, benzen dapat mengandung tiga ikatan pi. Ketiga ikatan pi dalam
cincin dapat dapat digambarkan menurut satu cara (rumus A), atau dapat
digambarkan menurut cara lain(rumus B).
Fakta-fakta dari struktur untuk benzena harus berikut:
- berisi cincin beranggota enam dan tiga derajat tambahan jenuh .
- Planar.
- Semua panjang C - C ikatan adalah sama.
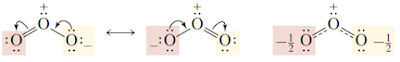
Struktur kekule memenuhi dua kriteria pertama, tetapi tidak ketiga , karena memiliki tiga bolak π Obligasi berarti bahwa benzena harus memiliki tiga ikatan ganda pendek bergantian dengan tiga lagi ikatan tunggal.2. ResonansiResonansi adalah delokalisasi elektron pada molekul atau ion poliatomil tertentu dimana ikatanya tidak dapat dituliskan dalam satu struktur lewis. Struktur molekul atau ion yang mempunyai delokalisasi elektron disebut dengan struktur resonansi.struktur lewis digunakan bersama-sama untuk menjelasankan struktur molekul, sedangkan struktur resonansi dapat melambangkan struktur lewis, dengan hanya satu ikatan kovalen antara masing-masing pasangan atom. Namun struktur tersebut tidak tepat, melainkan ada osilasi antara ikatan rangkapa dengan elektron, saling berbolak-balik. Maka dari itu disebut dengan resonansi. Struktur yang sebenarnya mungkin saja adalah peralihan dari struktur resonan. Bentuk peralihan (intermediet) dari struk resonan disebut dengan hibrida resonan.Sifat Umum ResonansiMolekul atau ion yang dapat beresonansi mempunyai sifat-sifat berikut :1. Dapat ditulis dalam beberapa struktur lewis yang disebut dengan struktur resonan. Tetapi tidak satupun struktur tersebut melambangkan bentuk asli molekul yang bersangkutan.2. diantara struktur yang saling beresonansi bukanlah isomer. perbedaan antar struktur hanyalah pada posisi elektron, bukan posisi inti.3. masing-masing struktur lewis harus mempunyai jumlah elektron valensi dan elektron tak berpasangan yang sama.4. ikatan yang mempunyai orde ikatan yang berbeda pada masing-masing struktur tidak mempunyai panjang ikakatan yang khas.5. Struktur yang sebenernya mempunyai energi yang lebih rendah dibandingkan energi masing-masing struktur resonan.



















assalamualaikum wr wb,saya ingin bertanya mengenai perbedaan dari atom oksigen dan atom nitrogen dalam hal hibridsasi, terimakasih
BalasHapuswalaikumsalam.wr.wb. perbedaan penting antara nitrogen dan oksigen, yaitu karbon mempunyai empat elektron untuk dibagikan dalam empat orbital sp3, sedangkan atom nitrogen mempunyai lima elektron yang didistribusikan dalam empat orbital sp3. Satu orbital sp3 dari nitrogen diisi dengan sepang elektron, dan nitrogen dapat membentuk senyawa dengan hanya tiga ikatan kovalen terhadap atom lain.
HapusSaya ingin bertanya kepada saudari Windy,pada sifat umum resonansi pada bagian nomor 2,bisakah saudari memberikan contoh dari pernyataan teesebut. Terimakasih
BalasHapusHasil percobaan menunjukkan bahwa hidrogenasi 1,3,5-sikloheksatriena melepaskan 86 kkal/mol kalor, sementara kalor yang dibebaskan bila benzena dihidrogenasi jauh lebih rendah yakni 49,8 kkal/mol. Hal ini menandakan bahwa benzena lebih sulit dihidrogenasi dibandingkan alkena. Apa yang menyebabkan hal itu bisa terjadi?
BalasHapusstruktruk bezena sulit di hidrogenasi karena struktur dari benzena lebih kaku (tegar) sehinga susah di hidrogenisasi atau bisa di katakan struktur benzena lebih stabil di bansingkan dengan alkena.
Hapus