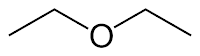SISTEM
NOMENKLATUR
Senyawa
karbon banyak di temukan dan banyak jeisnya, tetapi belum diketahui struktur
dan nama untuk mengidentivikasinya. Pada awalnya ilmuan kimia memberi nama
berdasarkan pada sumber atau sifat tertentu dari senyawa karbon yang baru. Contoh
pemberian nama pada asam sitrat yag ditemukan pada buah sitrum, asam urat yang
ditemukan pada urine, asam format terdapat pada semut (dalam bahasa latin semut
disebut formica). Penamaan seperti ini disebut nama trivial. Kemudian pada
tahun 1892 para ahli kimia membuat peraturan untuk penamaan kimia organik. Untuk
penamaan senyawa karbon diperlukan cara penamaan yang sistematis, untuk memberi
informasi tentang rumus molekul dan strukturnya. Sistem yang di kembangkan itu
disebut sistem nomenklatur IUPAC (International Union of Pure and Applied
Chemistry).
Sistem
nomenklatur atau disebut juga dengan sistem tatanama yang pertama ada prefix
atau cabang, parent adalah rantai atom karbon induk, dan akiran yang disebut suffix.sistem
omenklatur digunakan untuk menjelasakan jenis dan posisi gugus fungsi pada
suatu senyawa. Pada senyawa hidrkarbon, penamaan dapat dimilai dengan
menentukan rantai hidrokarbon Ingold Prelog jika Ambiguitas masih ada pada
struktur rantai hidrokarbon induk. Nama rantai induk dimodifikasi dengan
akhiran gugus fungsi yang memiliki prioritas tertinggi, sedangkan gugus fungsi
sisanya diindikasikan dengan awalan yang dinomori dan disusun secara alfabetis.
Untuk
komunikasi umum dan menghindari deskripsi yang panjang, rekomendasi penamaan
resmi IUPAC tidak selalu diikuti dalam praktiknya kecuali jika diperlukan untuk
memberikan definisi ringkas terhadap suatu senyawa atau
jika nama IUPAC lebih sederhana (bandingkan etanol dengan
etil alkohol). Jika tidak, maka nama umum atau nama trivial yang
biasanya diturunkan dari sumber senyawa tersebutlah yang digunakan.
Isomer
Struktural
Isomer
adalah senyawa kimia yang memiliki rumus molekul yang sama, jumlah dan jenis
atom yang sama tetapi memiliki struktur atau pengaturan yang berbeda dalam
ruang atau hubungan ikatanya yang berbeda. Isomer struktural karbon tidak
dibatasi hanya untuk karbon dan hidrogen.
Isomer
dapat dibedakan menjadi 2, yaitu sebagai berikut :
1. Isomer konstitusional, yaitu memiliki ciri perbedaa hubungan ikatan atom-atom.
Ø Isomer struktural, contohnya n-butana dengan –metil propana, 1-butanol dengan 2-butano.
Ø Isomer fungsional, yaitu senyawa dengan rumus molekul sama tetapi memiliki gugus fungsi yang berbeda. Contohnya, 1-butanol dengan dietileter.
2. Isomer stereoisomer (ruang), yaitu senyawa-senyawa yang memiliki rumusan molekul sama tapi susunan ruangnya berbeda.
Ø Enantiomer digunakan untuk menyatakan hubungan antara dua molekul yang merupakan bayangan cermin antara molekul satu dengan molekul yang lain.
Ø Diastereomer, adalah isomer ruang antar molekul yang tidak merupakan bayangan cermin satu sama lain. Contohnya cis dan trans.
Dalam isomer struktural atom diatur dalam susunan yang berdeda-beda. Isomer struktural terjadi ketika dua atau lebih senyawa organik memiliki rumus molekul sama, tetapi struktur yang berbeda.dengan perbedaan-perbedaan ini menyebabkan molekul kimia dan sifat fisik yang berbeda. Isomer struktural dapat dibagi menjadi 3 yaitu :
A. Isomer Rangka Atau Rantai
Isomer
rangka atau rantai terjadi karena adanya perbedaan rangka atau rantai yang
terjadi antara senyawa rantai lurus denga seyawa yang memiliki cabang, bisa
pula antara senyawa yang memiliki cabang, namun berbeda pada posisi dan jumlah
cabang. Isomer rangka atau rantai memiliki rumus molekul yang sama tetapi
berbagai jenis rantai, yaitu linier dan cabang.
Sifat
kimia pada isomer rangka adalah hampir sama tetapi sifat fiiknya berbeda.
Contohnya isomer rantai bercabang memiliki titik didih lebih rendah
dibandingkan dengan isomer rantai linier memiliki titik didih lebih tinggi. Hal
ini terjadi karena luas permukaan yang dimiliki oleh rantai linier lebih banyak
kontak dan karenaya kekuatan tarik menarik antara molekul yang maksimum.
B. Isomer Posisi
Isomer posisi adalah isomer yang terjadi karena
perbedaan posisi ikatan rangkap. Isomer ini hanya terjadi pada senyawa
hidrokarbon tak jenuh (alkena dan alkuna). Isomer posisi juga ditemukan pada
cinci benzen, contoh senyawa benzen yang memiliki isomer posisi adalah C7H8Cl.
Kemungkinan terdapat empat isomer pada senyawa C7H8Cl
tergantung pada posisi atom klorin. Dalam satu kasus itu melekat pada atom
karbon samping kelompok, dan kemudian ada tiga kemungkinan posisi lain bisa
memiliki sekitar ring-samping grup CH3, next-tapi-satu untuk kelompok CH3,
atau sebaliknya kelompok CH3.
C. Isomer Fungsional
Dalam
berbagai ini isomer struktural, isomer mengandung gugus fungsional yang berbeda
yaitu, mereka milik keluarga yang berbeda dari senyawa (seri homolog yang
berbeda).
D. Isomer Geometri
Isomer
geometri adalah senyawa-senyawa yang mempunyai rumus molekul sama tetapi
struktur ruangnya berbeda. Isomer geometri disebabkan oleh susunan atom dalam
ruang. Jadi bila ada 2 senyawa hidrokarbon yang bentuk strukturnya sama, baik
kerangkanya maupun letak gugus fungsionalnya sama, masih mungkin berbeda jenis
jika susunan atom dalam ruangnya berbeda. Untuk lebih jelasnya akan diuraikan
dalam 2 macam bentuk isomer geometri di bawah ini :
1. Isomer Cis-Trans
Alkena
mempunyai 2 contoh isomer geometri yaitu cis dan trans. Syarat utama terbentuk
isomer Cis-Trans adalah terdapat ikatan rangkap dua (C=C) yang tiap-tiap karbon
(C) dalam ikatan rangkap tersebut mengikat atom atau gugus atom yang berbeda. Untuk
membedakan Alkena yang mempunyai isomer Cis-Trans atau tidak.
2.Isomer
optis aktif
Isomer
optis aktif terjadi pada senyawa karbon yang mengandung C kiral. Coba lihat
Atom C yang berwarna coklat dibawah, atom C tersebut keempat tangannya mengikat
4 atom (gugus atom) yang berbeda.
Isomer
pada Alkana
Alkana
mempunyai struktur ratai lurus atau bercabang, tidak mempunyai ikatan rangkap
dua atau rangkap tiga. Atom-atom dalam suatu molekul diatur dalam suatu rangkai
maupun dalam bentuk cincin. Alkana ada yang juga disebut hidrokarbon jenuh
dimana hidrokarbon jenuh hanya mengandung ikatan tunggal dan juga dikenal
dengan alkana alifatik dan alkana asiklik. Oleh karena itu alkana dicirikan
adanya atom atom karbon tetrahedral atau sp3, contohnya adalah metana (CH4)
dan etana (C2H6). Gugus yang dihasilkan jika satu atom H
dihilangkan dari alkana disebut dengan gugus alkil. Misalnya gugus metil dari
metana dan gugus etil dari etana. Pada senyawa
alkana, keisomeran dimulai dari senyawa dengan rumus kimia C4H10. senyawa alkana juga ada yang rumus
molekulnya sama, tetapi rumus struktur molekulnya berbeda.
Kemampua
atom-atom karbon membentuk ikata yang kuat dan stabil dengan atom-atom karbon
lain menghasilkan isomer-isomer struktur dengan jumlah yang sangat bayak. Alkana
dengan rumus molekul C5H12 mempunyai 3 isomer struktur,
alkana dengan rumus molekul C10H22 berturut-turut
mempunyai 75 isomer dan hampir 37 juta isomer struktur.